Numerosi processi metabolici e fisiologici sono sostenuti da oscillazioni biologiche di 24 ore che sono sotto il controllo di un orologio circadiano centrale, presente in tutte le cellule mammifere (1). La sincronizzazione dell’espressione dei geni dell’orologio circadiano nel nucleo sopra-chiasmatico (SCN) dell’ipotalamo è principalmente governata dal ciclo luce-buio (1). Tuttavia, altri indicatori di tempo ambientali e comportamentali, chiamati “zeitgebers” o “indicatori temporali”, come l’ora dei pasti e dell’esercizio fisico, insieme ai cicli sonno-veglia, possono “mettere a punto” l’orologio centrale (2). Questi segnali non fasici possono ripristinare o indurre cambiamenti di fase temporale nelle oscillazioni circadiane attraverso meccanismi indipendenti dal SCN (3,4). In effetti, il nostro stile di vita moderno prevalente (accesso 24 ore su 24 a cibi ricchi di energia, bassi livelli di attività fisica abituale accompagnati da periodi di seduta prolungata e qualità / quantità di sonno inadeguata) interagisce con la biologia, per creare un ambiente in cui i ritmi circadiani sono interrotti, causando spesso una eccessiva quantità di condizioni metaboliche (3-5). Non è stato sempre così. Durante l’evoluzione umana, lo stile di vita e la disponibilità di energia erano indissolubilmente legati ai cicli periodici di feste e carestie. Durante questi cicli naturali, specifici geni si sono evoluti per regolare l’archiviazione efficiente delle riserve di combustibile endogeno, i cosiddetti geni frugali (6). Durante il primo periodo dei cacciatori – raccoglitori, c’era anche la selezione di geni e tratti a supporto di un “ciclo di attività fisica” (7,8), e sotto questi vincoli, la maggior parte dell’attuale genoma umano si è evoluto. Oggi, quegli alleli e tratti che si sono evoluti per la conservazione dell’energia e la locomozione sono esposti a una miriade di segnali ambientali sfavorevoli per una durata di vita estesa, perturbando l’orologio circadiano intrinseco e aumentando il rischio di molte malattie metaboliche indotte dallo stile di vita (3-5). In questa prospettiva di progresso, ecco qui un sommario dell’efficacia degli interventi sulla dieta e sull’esercizio fisico per salvare molti degli effetti deleteri sulla biologia circadiana indotti dal nostro stile di vita moderno. Nuove intuizioni sugli effetti comparativi e potenziali complementari dell’allenamento fisico e un nuovo intervento dietetico che incoraggia una durata giornaliera più lunga del digiuno per migliorare la salute metabolica umana, anche se i ricercatori sostengono che l’esercizio fisico rimane ancora la strategia ottimale per migliorare la maggior parte degli stili di vita indotti da disturbi del metabolismo.
STRATEGIE PER MIGLIORARE LA SALUTE METABOLICA
Il vantaggio di migliorare la qualità della dieta unita all’esercizio fisico regolare è senza dubbio l’approccio migliore per prevenire e curare le malattie non trasmissibili (9). Tuttavia, l’adesione da parte della popolazione alle modifiche dello stile di vita è scarsa e tali cambiamenti comportamentali hanno avuto un successo limitato (10). Di conseguenza, le strategie di dieta ed esercizio fisico che si concentrano su interventi socialmente più accettabili e realizzabili (ad esempio, “pause” di esercizio dopo i pasti, modifica dei tempi di alimentazione, allenamento ad intervalli di sprint ad alta intensità – SIT) possono essere più efficaci per migliorare la salute metabolica (11–13). Le interazioni tra i tempi di esercizio e i pasti sono complesse: i cambiamenti nell’assunzione di energia e/o macronutrienti alterano rapidamente la concentrazione di substrati e ormoni trasportati dal sangue causando marcate perturbazioni nel profilo di conservazione del muscolo scheletrico e di altri tessuti sensibili all’insulina (14). A sua volta, lo stato energetico del muscolo esercita effetti marcati sul metabolismo del carburante a riposo e sui modelli di consumo di carburante durante l’esercizio (15), influenzando i processi regolatori acuti alla base dell’espressione genica e della segnalazione cellulare (16). Sebbene sia generalmente accettato che gli adattamenti all’esercizio fisico derivino dall’effetto cumulativo e cronico degli aumenti transitori delle trascrizioni dell’mRNA che codificano per varie proteine dopo ogni successivo esercizio (17), gli effetti cronici dei cambiamenti nell’ora dei pasti sono, per ora, sconosciuti.
– Interventi dietetici
Nell’ultimo decennio, si sono accumulate prove per suggerire che gli orari dei pasti influenzano un’ampia varietà di funzioni fisiologiche, tra cui il ciclo sonno/veglia, la temperatura corporea, le prestazioni atletiche e la prontezza mentale (2). Inoltre, l’ora dei pasti ha un profondo effetto sulla sensibilità all’insulina dei muscoli scheletrici e sulla salute metabolica del corpo intero (18) e può essere usato per aiutare a prevenire/trattare una serie di stati patologici legati allo stile di vita. Questo è stato definito “crono-nutrizione” e riflette un nuovo apprezzamento del fatto che i tempi dei pasti oltre al contenuto energetico e alla composizione macronutriente del cibo sono fondamentali per il benessere di un organismo. Quindi, la cronoalimentazione si riferisce alla sincronizzazione del mangiare con i ritmi circadiani guidati dal corpo (2).
Numerose strategie dietetiche sono state proposte per frenare la crescente ascesa dell’obesità e dei disturbi metabolici indotti dallo stile di vita. Una caratteristica comune alla maggior parte di queste diete è la gestione del ciclo di digiuno. A questo proposito, mangiare in orari limitati (time restricted eating – TRE), in cui l’assunzione di energia è limitata a una “finestra” inferiore a 10 ore al giorno, è emerso come un intervento pratico per aumentare la durata del tempo trascorso a digiuno, riducendo il tempo durante il quale viene consumata energia (Fig. 1). Gill e Panda (11) sono stati i primi a dimostrare che 16 settimane di TRE negli umani in sovrappeso (con un indice di massa corporea (BMI)> 25 kg/m2) hanno indotto una modesta perdita di peso (circa 3% della massa corporea) dopo aver diminuito la finestra nutrizionale da più di 14 ore, a meno o uguale a 10 ore al giorno. Questa perdita di peso è stata mantenuta per 12 mesi, suggerendo che TRE potrebbe essere una strategia pratica per il mantenimento del peso a lungo termine.
Sebbene ai partecipanti a tale studio (11) non sia stato chiesto di modificare la qualità o la quantità nutrizionale, la riduzione della durata giornaliera del consumo di cibo ha comportato una riduzione del 20% dell’apporto energetico (11), ma con un numero limitato di soggetti (cinque maschi e tre femmine) e nessun gruppo di controllo, l’interpretazione più ampia dei risultati di questo studio è limitata.
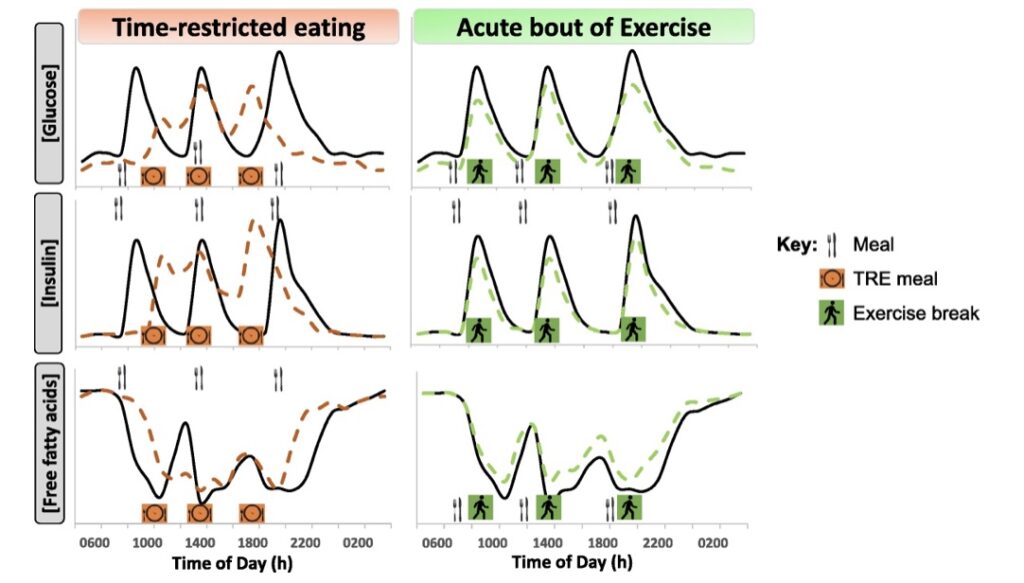
Figura 1: concentrazioni di glucosio, insulina e acidi grassi liberi (FFA) proposte per un periodo di 24 ore con un’alimentazione a orari limitati (TRE) (arancione, linee tratteggiate) o “brevi momenti d’esercizio fisico” (circa 10 minuti camminando; verde, linee tratteggiate) rispetto ai tipici modelli di metaboliti circolanti in risposta a tre pasti consumati durante le ore di veglia.
Altri studi dopo quello di Gill e Panda (11) confermano che TRE induce una modesta perdita di peso (19-21), sebbene questi interventi siano stati a breve termine (≤12 settimane) senza follow-up. Ad esempio, Gabel e altri (21) hanno riferito che 23 individui con obesità che hanno svolto 12 settimane di TRE (ore 10:00-18:00) per circa 5-6 settimane, hanno avuto una perdita di massa corporea del 2,6%. Altri hanno anche osservato piccole riduzioni dell’apporto energetico durante lo svolgimento di TRE per 8-10 ore al giorno (11,21,22), rendendo difficile attribuire la perdita di peso unicamente all’ora dell’assunzione di energia. Da notare che interventi dietetici a basso consumo energetico, senza stimolo all’esercizio fisico, inducono in genere una perdita di circa 250–300 g di tessuto magro per ogni chilogrammo di peso perso (23), e sebbene in TRE non siano state prese misure studio fino ad oggi, tali perdite nella massa magra dovrebbero essere simili agli interventi di digiuno dietetico (24).
I risultati di uno studio recente suggeriscono che i benefici per la salute di TRE possono essere indipendenti dalla perdita di peso (25). Nella prima sperimentazione supervisionata di TRE precoce (eTRE), in cui tutti i pasti venivano forniti ai partecipanti, Sutton e altri (25) hanno studiato otto uomini con pre-diabete che sono stati randomizzati a eTRE (pasti consumati entro 6 ore, ultima assunzione di energia, prima delle ore 15:00) o uno schema alimentare illimitato (pasti consumati in 12 ore, dalle ore 8:00 alle 20:00) per 5 settimane. Non sono state valutate misure di composizione corporea o attività fisica. Rispetto all’alimentazione senza restrizioni, eTRE ha migliorato la sensibilità all’insulina e la reattività delle cellule B, la pressione sanguigna e lo stress ossidativo, sebbene siano state modificate anche determinate misure di appetito (25). I meccanismi precisi su come TRE migliora i risultati sulla salute senza restrizioni energetiche forzate sono attualmente sconosciuti.
L’orologio circadiano influisce sul metabolismo ormonale, con le ore dei pasti che perfezionano la biologia endocrina per quanto riguarda il controllo glicemico (26). Un afflusso di glucosio dalla produzione di glucosio epatico stimolato dal cortisolo si verifica intorno alle ore 8:00, quando i livelli di cortisolo in genere raggiungono il picco dopo il risveglio (27). Ritardare (non saltare) la colazione fino a tarda mattinata (circa verso le ore 10:00) e perdere il rilascio circadiano-correlato di glucosio epatico (28) potrebbe migliorare il controllo glicemico postprandiale (Fig. 1). Anche la secrezione e la sensibilità all’insulina sono regolate dalla regolazione circadiana: questi parametri vedono un aumento nelle prime ore del giorno e diminuiscono la sera (28), anche quando ci sono digiuni equidistanti di 12 ore tra i pasti (29). Pertanto la riduzione della sensibilità all’insulina la sera spiega l’alterata tolleranza al glucosio misurata in risposta al consumo della cena a tarda notte (30,31).
Una domanda importante sia per i risultati sulla salute che per la praticità dell’attuazione degli interventi TRE è se la finestra dell’ora pasti del giorno, così come l’ora di inizio/ fine dei pasti, sia associata all’entità del miglioramento dei marcatori di salute. L’intervento eTRE di Sutton e altri (25) ha rivelato che l’iperinsulinemia si riduceva quando il consumo giornaliero veniva completato alle ore 15:00, ma un protocollo alimentare così rigoroso non è probabilmente pratico o socialmente accettabile. Gli studi di TRE “tardivo”, o quando l’assunzione totale di energia era limitata ai pasti consumati dopo le ore 16:00, hanno portato a una riduzione della glicemia a digiuno, una riduzione della tolleranza al glucosio e un aumento della fame (32,33). Gli studi che hanno iniziato TRE a metà giornata non hanno mostrato alcun effetto (21) o tendevano a essere utili per quanto riguarda il controllo glicemico (19,22). Nell’unica studio comparativa di TRE eseguito fino ad ora, Hutchison e altri (34), hanno fatto una comparazione tra 1 settimana di eTRE (ore 08:00 – 17:00) e TRE ritardato (ore 12:00 – 21:00) in uomini a rischio di sviluppare diabete di tipo 2 (T2D). Entrambi i protocolli hanno migliorato il controllo glicemico in risposta ad un test sul pasto, ma solo eTRE ha migliorato i livelli di glucosio a digiuno durante la notte (34). Chiaramente, c’è un compromesso tra la fattibilità di TRE e l’adesione a una finestra TRE ottimale che si allinea ai ritmi circadiani sani. Di conseguenza, studi futuri dovrebbero determinare se è il posizionamento della finestra alimentare o la durata trascorsa in uno stato di digiuno, ogni giorno, induce molti dei miglioramenti nella salute metabolica.
Gli ormoni che inducono la sazietà peptide-1 simile al glucagone (GLP-1), peptide inibitore del glucosio (GIP) e peptide YY (PYY), sono aumentati e l’ormone che induce la fame è risultato soppresso, in risposta ai pasti. Questi ormoni intestinali svolgono un ruolo fondamentale nel modulare l’appetito e il tasso di svuotamento gastrico (che rallenta la sera) e, quindi, la risposta glicemica ai pasti. La secrezione di questi ormoni è soggetta alla regolazione circadiana (35). Ad esempio, la grelina rilascia picchi a metà sera (intorno alle ore 20:00 circa) ed è più bassa al risveglio (36), spiegando, in parte, la forte spinta biologica a mangiare di notte. Pertanto, è probabile che le diete che promuovono un maggiore apporto energetico al mattino e un apporto energetico più basso (o un digiuno più lungo) alla sera producano una perdita di peso sostenuta (37,38). Forse sorprendentemente, le valutazioni soggettive dell’appetito non sono aumentate da TRE, almeno quando misurate durante il giorno (11,25). TRE iniziato alle ore 8:00 fino alle 17:00 o alle ore 12:00 fino alle 21:00, non ha alterato la soppressione postprandiale della grelina o l’aumento della risposta PYY, GLP-1 o GIP e non vi sono state differenze nelle valutazioni dell’appetito soggettivo durante il pasto (34).
Ridurre il tempo trascorso in uno stato post-prandiale e post-assorbimento migliora la glicemia (39) spostando contemporaneamente i modelli di utilizzo del substrato. Il digiuno prolungato (> 24 ore) aumenta la produzione di corpi chetonici nell’uomo (40) e i tassi di ossidazione dei grassi di tutto il corpo. È probabile che periodi di digiuno prolungati sovra regolino l’ossidazione dei grassi attraverso un aumento della lipolisi e degli acidi grassi liberi circolanti (FFA). Durante una tipica giornata di consumo calorico (ovvero tre pasti più spuntini), le concentrazioni di FFA e trigliceridi (TG) circolanti vengono soppresse (41) e il consumo prolungato di energia (> 14 ore al giorno) limita la lipolisi e i tassi di ossidazione di FFA a riposo. Un digiuno prolungato durante la notte con TRE aumenta gli aumenti di FFA e TG, con conseguente aumento dei profili lipidici a digiuno (25). Resta da stabilire se tale profilo lipidico sia benefico per la salute umana a lungo termine. Ad oggi, i risultati di studi sugli animali rivelano che le riserve di grasso epatico sono ridotte con TRE (42), ma sono necessarie ulteriori ricerche sull’uomo per comprendere l’effetto di TRE sul metabolismo lipidico di tutto il corpo ed epatico.
In termini di sostenibilità, TRE sembra offrire un vantaggio pratico rispetto a interventi dietetici più restrittivi di energia, dato che non esistono istruzioni specifiche sulla restrizione energetica o sulle scelte alimentari discrezionali. Tuttavia, i tipi di alimenti che consumiamo spesso sono allineati strettamente a momenti distinti della giornata; l’alcol in genere viene consumato alla fine della giornata, così come gli alimenti dolci (zucchero raffinato) come il gelato (11). Una riduzione dell’assunzione di cibo nel corso della giornata potrebbe non solo ridurre l’assunzione totale di energia, ma anche ridurre l’assunzione di cibo discrezionale e migliorare la qualità della dieta generale (37,43-45). Tuttavia è anche possibile che imporre restrizioni temporali sul cibo possa comportare scelte alimentari più povere in alcuni individui.
– Interventi di allenamento
TRE estende il periodo di tempo a digiuno (Fig. 1), inducendo diverse risposte simili a quelle osservate dopo l’allenamento (Fig. 2). Tuttavia, se confrontato con gli interventi dietetici soliti, sia l’ampiezza, che l’estensione delle risposte e degli adattamenti indotti dall’allenamento sono probabilmente maggiori in un confronto diretto (Fig. 2).
Le prove di tale premessa provengono da dati epidemiologici che dimostrano che l’associazione tra bassa fitness cardiometabolica (cioè basso assorbimento massimo di ossigeno) e mortalità per tutte le cause è più forte di quella dell’obesità (cioè alto indice di massa corporea) (46).
L’allenamento ritarda l’insorgenza di almeno 40 condizioni/malattie metaboliche croniche (47,48). Tuttavia, è stato difficile convincere le persone a rispettare anche la quantità minima raccomandata e la qualità dell’esercizio necessario a conferire benefici per la salute (10).
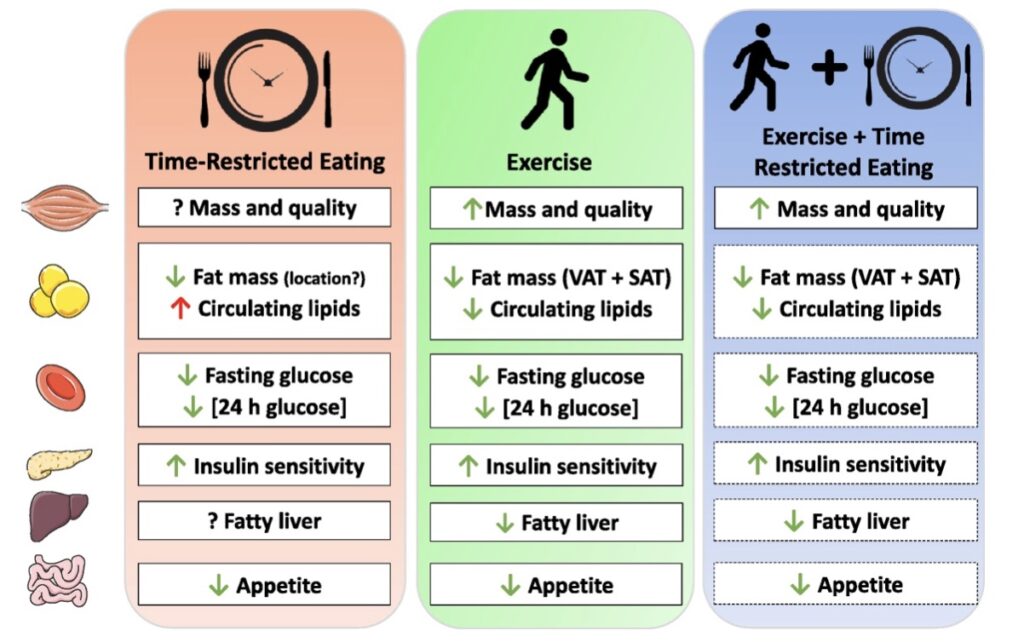
Figura 2: Effetti dell’alimentazione a tempo limitato (TRE) e dell’allenamento, sulla salute metabolica nell’uomo (riquadro a bordi interi, ciò che è noto; riquadro a bordi tratteggiati, ciò che viene proposto). Frecce verdi, cambiamento positivo; frecce rosse, cambiamento negativo; ?, effetto sconosciuto; SAT, tessuto adiposo sottocutaneo; VAT, tessuto adiposo viscerale.
L’allenamento ha un impatto significativo sulla composizione corporea, riducendo sia il grasso sottocutaneo che quello viscerale (49) e preservando la massa magra (23). L’esercizio a base aerobica di durata/intensità sufficienti promuove cambiamenti benefici nel metabolismo di tutto il corpo e riduce la massa grassa (50), mentre l’esercizio contro resistenza o di forza, preserva o aumenta la massa magra (51,52).
Le diete a basso consumo di energia da sole sono efficaci strategie a breve termine per una rapida perdita di peso, ma comportano una riduzione della massa grassa e muscolare, predisponendo una composizione corporea sfavorevole e una prognosi sfavorevole.
L’esercizio fisico comporta in genere solo un modesto aumento del dispendio energetico giornaliero totale, ma ha effetti minimi sulla perdita di peso a lungo termine, a seconda del volume/intensità dell’esercizio eseguito (23). Come tale, l’esecuzione di un esercizio regolare e appropriato è l’unico meccanismo per migliorare la composizione corporea (cioè perdere la massa grassa, mantenendo la massa magra). Per un individuo focalizzato esclusivamente sulle variazioni di peso, la riduzione a breve termine della massa corporea con TRE può inizialmente superare quella dell’esercizio, mascherando eventuali modifiche a lungo termine indotte dall’esercizio alla composizione corporea. Sono urgentemente necessari studi a lungo termine su TRE che incorporano misure di composizione corporea per comprendere gli effetti indotti dalla più lunga durata del digiuno quotidiano.
Sebbene gli interventi TRE abbiano il potenziale di cambiare le abitudini alimentari, potrebbero esserci anche cambiamenti nelle tipologie di attività fisica (53,54). L’effetto di aumentare la quantità di esercizio in base all’assunzione dalla dieta, tuttavia, appare equivoco; gli aumenti dell’attività fisica non hanno avuto alcun effetto (55,56) o hanno portato a un miglioramento (57) della qualità dietetica.
Negli adulti più anziani con pre-diabete, eseguire regolarmente esercizi di contro resistenza ha ridotto l’assunzione di carboidrati, zucchero, dolci e dessert auto-segnalati, con scarso effetto sull’assunzione di proteine (58). Tali cambiamenti nell’assunzione totale di energia e macronutrienti possono essere correlati ai cambiamenti nella regolazione dell’appetito con l’esercizio. L’attività fisica acuta reprime temporaneamente l’appetito sia negli individui magri, che in quelli obesi (59), attraverso una soppressione della grelina e aumenta il PYY e il GLP-1 (60). Tuttavia, gli effetti dell’allenamento a lungo termine sul controllo dell’appetito sono equivoci (61,62). L’allenamento può bilanciare le risposte dell’appetito con una maggiore risposta di sazietà a un pasto, nonostante un aumento del desiderio di mangiare (63,64).
L’allenamento riduce anche le concentrazioni circolanti di leptina, riducendo la massa grassa e influenza positivamente l’appetito e la composizione corporea (65,66). Pertanto, l’esercizio fisico ha la capacità di ridurre l’appetito e migliorare l’assunzione alimentare complessiva. Ad oggi, non ci sono stati interventi di TRE in combinazione con un programma di allenamento, rispetto al solo TRE.
Un singolo periodo di esercizio aumenta l’assorbimento del glucosio nei muscoli scheletrici (67). Tuttavia questo effetto “insulino-sensibilizzante” è di breve durata e si dissipa dopo circa 48 ore (68). Al contrario, la ripetuta attività fisica (cioè l’allenamento fisico) provoca un aumento persistente dell’azione dell’insulina nel muscolo scheletrico da parte di individui sani e persone con insulino-resistenza e obesità (69). L’allenamento fisico migliora anche la tolleranza al glucosio (70). Il volume preciso di esercizio richiesto per indurre un cambiamento clinicamente significativo della glicemia è una questione controversa, ma piccola rispetto al tempo trascorso svegli. Dempsey e altri (12,71) hanno riferito che meno di 40 minuti di esercizi di camminata o di forza a corpo libero (una serie di 12 × 3 minuti, intrapresi tra le ore 9:00 e le 15:00) hanno migliorato le concentrazioni di glucosio sia di girono, che di notte, in soggetti con diabete di tipo 2.
Un piccola fase di esercizio (snack esercise) in serie di 3 × 10 minuti dopo i pasti ha migliorato il controllo glicemico giornaliero in soggetti con diabete di tipo 2 molto di più rispetto a una camminata continua di 30 minuti (72). Nei soggetti con pre-diabete, tre “snack exercise” (6 × 1 min di attività ad alta intensità prima di ogni pasto) hanno migliorato la glicemia giornaliera sia il giorno dell’esercizio, che nelle 24 ore successive (13). Pertanto, un’adeguata attività fisica, indipendentemente dal modo in cui viene accumulata nel corso della giornata, è efficace nell’attenuare le concentrazioni postprandiali di glucosio e insulina (Fig. 1).
L’esercizio fisico regolare aumenta i tassi post-esercizio di ossidazione dei grassi di tutto il corpo e migliora la flessibilità metabolica (la capacità di rispondere ai cambiamenti nell’ambiente ormonale e di passare da una fonte di carburante all’altra in risposta alla domanda metabolica prevalente) (73). L’esercizio fisico ha anche un effetto positivo sui profili lipidici circolanti, con diminuzione delle concentrazioni di FFA a digiuno e postprandiale, aumento dell’assorbimento di FFA da parte dei muscoli e riduzione dell’assorbimento di FFA nel fegato (74), contribuendo al miglioramento della malattia epatica non alcolica (75) .
Una meta-analisi di programmi di allenamento con esercizi aerobici eseguiti per 12 settimane ha riportato la riduzione di trigliceridi circolanti e lipoproteine ad alta densità (HDL), lipoproteine a bassa densità e colesterolo totale (76). Sono state anche osservate riduzioni del colesterolo e dei lipidi circolanti sia in risposta a una singola serie di esercizio basato sulla contro resistenza (77), che dopo l’allenamento di contro resistenza (78), sebbene l’entità della riduzione sia in genere inferiore a quella osservata dopo l’allenamento di esercizio aerobico. Anche brevi periodi di attività fisica per un totale di circa 40 minuti al giorno migliorano la gestione postprandiale dei lipidi (79).
I tempi ottimali dell’esercizio per massimizzare i benefici per la salute sono attualmente sconosciuti e probabilmente confusi da una serie di variabili (stato di salute dell’individuo, tempo di veglia, fenotipo circadiano, modalità e durata/intensità dell’esercizio e orario dei pasti). Le prestazioni acute dell’esercizio a base aerobica (ad es., allenamento ad intervalli continui o ad alta intensità) nel pomeriggio/sera migliorano il controllo glicemico (72,80), probabilmente a causa dei tempi in relazione alla resistenza all’insulina circadiana e allo stato postprandiale (81).
L’esercizio di forza eseguito al mattino, al pomeriggio o alla sera migliora la generazione di forza (cioè la forza muscolare) (82,83). Tuttavia, non esiste un chiaro consenso riguardo ai vantaggi dell’esercizio fisico mattutino o serale, in merito a miglioramenti superiori della capacità aerobica (84) o all’allenamento di contro resistenza/adattamento della forza (85).
Sebbene sia stato recentemente proposto che l’ora del giorno sia un importante modificatore delle risposte/adattamenti dell’esercizio e delle relative vie metaboliche (86) e che esista un ritmo diurno-notturno nell’espressione di mRNA dei geni dell’orologio molecolare nel muscolo scheletrico umano (87), i ricercatori pongono cautela riguardo alle raccomandazioni sul “momento ottimale della giornata” che eserciti benefici ottimali per la salute: lo stato di salute individuale (cioè malattie cardiovascolari e/o ipertensione conosciute), obiettivi di esercizio personale e fattibilità, dovrebbero essere tutti presi in considerazione.
– TRE ed allenamento: alcune considerazioni
La scoperta di “dialoghi” tra muscoli e altri organi, inclusi tessuto adiposo, fegato, pancreas, ossa e cervello, fornisce un quadro per comprendere come l’esercizio fisico media molti dei suoi effetti benefici su tutto il corpo (88). Sebbene diverse risposte acute al TRE siano simili a quelle ottenute dopo l’allenamento (Fig. 2), l’esercizio evoca il rimodellamento diffuso ed esteso di quasi tutti gli organi/tessuti del corpo (ad esempio, aumento della densità minerale ossea, miglioramento della dinamica cardiovascolare e del flusso sanguigno, aumenti della capacità ossidativa muscolare e capillarizzazione, aumenti della sezione trasversale muscolare, ecc.). In effetti, è proprio la complessità e la molteplicità delle reti coinvolte nelle risposte all’esercizio che rendono improbabile che tali effetti su tutto il corpo possano essere indotti da TRE.
Non è stato studiato sistematicamente se l’aggiunta di allenamento fisico a un regime TRE o l’integrazione di un programma di esercizi con TRE conferisca ulteriori benefici al di là di entrambi gli interventi in isolamento. Fino ad oggi, solo due interventi TRE nell’uomo hanno incluso l’esercizio fisico in aggiunta alle modifiche ai tempi dietetici (19,89). Moro e altri (19) hanno studiato maschi sani durante 8 settimane di allenamento di forza: un gruppo che si sottoponeva a questo a giorni alterni dopo il TRE (ore 13:00 – 20:00) e un gruppo che non aveva restrizioni nel mangiare (ore 08:00 – 20:00), i quali però assumevano la stessa quantità di energia. Sebbene entrambi i gruppi abbiano aumentato la massa muscolare dopo l’intervento, solo il gruppo TRE ha ridotto la massa corporea totale e la massa grassa, con piccoli, ma concomitanti miglioramenti positivi in diversi marker di salute metabolica (miglioramento del profilo glicemico, HDL e TG) (19).
Tinsley e altri (89) hanno esaminato gli effetti di 8 settimane di allenamento di forza (3 giorni a settimana) con o senza TRE. Il protocollo TRE consisteva nel consumare tutti i pasti in un lasso di tempo di 4 ore tra le ore 16:00 e la mezzanotte nei giorni di non allenamento (4 giorni a settimana), senza limiti di quantità o tipi di alimenti scelti. La condizione del gruppo di “controllo” era di allenamento forza senza restrizioni sull’assunzione di energia nei giorni di non allenamento. Il TRE ha comportato una riduzione del 10% dell’apporto energetico, rispetto al gruppo di controllo, ma non ha conferito ulteriori miglioramenti nella composizione corporea e non sono stati misurati i marker di salute metabolica (89). I test in seguito a ciò hanno rivelato un piccolo effetto positivo dell’allenamento di forza sull’aumento della massa magra nel solo gruppo di controllo, che era probabilmente dovuto alla maggiore assunzione di proteine (1,4 vs 1,0 g per kg di massa corporea) nel gruppo di controllo rispetto al gruppo TRE. Pertanto, gli effetti aggiuntivi di TRE all’esercizio fisico possono dipendere dagli effetti che TRE ha sia sull’energia giornaliera totale, che sull’assunzione di proteine, nonché sulla tempistica dell’ingestione proteica rispetto a quando viene eseguito l’esercizio.
In altri interventi di TRE, i partecipanti sono stati istruiti “a non modificare i livelli di attività fisica” (20,21,34) o non vi è stato alcun controllo dell’attività fisica (11,22). Non ci sono studi che analizzino il potenziale beneficio aggiuntivo dell’allenamento con un regime dietetico di TRE rispetto al solo TRE. Dato che la qualità e la quantità della dieta non sono nettamente migliorate quando le persone intraprendono un’attività fisica regolare, l’integrazione dell’allenamento con TRE può aiutare a modificare i modelli comportamentali di alimentazione (cioè ridurre gli spuntini di fine giornata/consumo di alcol) e migliorare i benefici generali per la salute. Per le persone con condizioni mediche in cui l’attività fisica non può essere svolta, TRE offre una strategia fattibile per migliorare o mantenere la salute metabolica. Tuttavia prevediamo che per la maggior parte degli individui “sani” l’aggiunta di TRE a un programma di regolare attività fisica darebbe effetti aggiuntivi minimi su una serie di risultati relativi alla salute.
PROSPETTIVE FUTURE
La salute cardiometabolica ottimale per le persone a rischio di malattie croniche legate allo stile di vita deriva da interventi in cui l’assunzione dietetica è ridotta, la qualità è migliorata e quando viene svolto esercizio fisico con modalità, durata e intensità concrete (23,90). Tuttavia far si che vi siano cambiamenti nei modelli dietetici abituali è spesso considerata più arduo della terapia medica (91) e la maggior parte degli individui riferisce che “la mancanza di tempo” è la ragione principale per cui non si fa esercizio fisico regolare (92).
In quanto tale, il dibattito diventa “quale priorità dovrebbe essere data alla modifica della dieta, rispetto all’attuazione dell’allenamento per migliorare i risultati sulla salute?” Poiché l’energia, attraverso il cibo, è necessaria per sostenere la vita, forse non sorprende che le modifiche dietetiche siano spesso le prime in linea di attacco nell’arsenale d’interventi sullo stile di vita per prevenire/curare molte malattie metaboliche. Sebbene sia disponibile un ampio menù di opzioni dietetiche per migliorare i risultati sulla salute metabolica, il loro successo/fallimento, come con qualsiasi intervento di esercizio, dipende dall’adesione a lungo termine (93). Riteniamo che l’allenamento fisico effettuato in conformità con le linee guida nazionali e internazionali dia maggiori benefici per la salute metabolica di tutto il corpo e dei tessuti rispetto a qualsiasi intervento dietetico attuale. Resta da stabilire sperimentalmente se TRE nell’uomo conferisca benefici aggiuntivi al metabolismo disordinato, al di là di quelli indotti dall’allenamento.
Approfondimento da: “A Time to Eat and a Time to Exercise” Parr, Evelyn B.; Heilbronn, Leonie K.; Hawley, John A., Exercise and Sport Sciences Reviews: January 2020 – Volume 48 – Issue 1 – p 4-10, American College of Sports Medicine
Riferimenti Bibliografici
1. Eckel-Mahan K, Sassone-Corsi P. Metabolism and the circadian clock converge. Physiol. Rev. 2013; 93:107–35.
2. Challet E. The circadian regulation of food intake. Nature Reviews Endocrinology [Internet]. [Cited 2019 May 9].
3. Asher G, Sassone-Corsi P. Time for food: the intimate interplay between nutrition, metabolism, and the circadian clock. Cell. 2015; 161:84–92.
4. Panda S. Circadian physiology of metabolism. Science. 2016; 354:1008–15.
5. Gabriel BM, Zierath JR. Circadian rhythms and exercise—re-setting the clock in metabolic disease. Nat. Rev. Endocrinol. 2019; 15:197–206.
6. Neel JV. Diabetes mellitus: a “thrifty” genotype rendered detrimental by “progress”? Am. J. Hum. Genet. 1962; 14:353–62.
7. Booth FW, Chakravarthy MV, Gordon SE, Spangenburg EE. Waging war on physical inactivity: using modern molecular ammunition against an ancient enemy. J. Appl. Physiol. 2002; 93:3–30.
8. Chakravarthy MV, Booth FW. Eating, exercise, and “thrifty” genotypes: connecting the dots toward an evolutionary understanding of modern chronic diseases. J. Appl. Physiol. 2004; 96:3–10.
9. Pedersen BK, Saltin B. Exercise as medicine—evidence for prescribing exercise as therapy in 26 different chronic diseases. Scand. J. Med. Sci. Sports. 2015; 25:1–72.
10. Guthold R, Stevens GA, Riley LM, Bull FC. Worldwide trends in insufficient physical activity from 2001 to 2016: a pooled analysis of 358 population-based surveys with 1.9 million participants. Lancet Glob. Health. 2018; 6:e1077–86.
11. Gill S, Panda S. A smartphone app reveals erratic diurnal eating patterns in humans that can be modulated for health benefits. Cell Metab. 2015; 22:789–98.
12. Dempsey PC, Sacre JW, Larsen RN, et al. Interrupting prolonged sitting with brief bouts of light walking or simple resistance activities reduces resting blood pressure and plasma noradrenaline in type 2 diabetes. J. Hypertens. 2016; 34:2376–82.
13. Francois ME, Baldi JC, Manning PJ, et al. “Exercise snacks” before meals: a novel strategy to improve glycaemic control in individuals with insulin resistance. Diabetologia. 2014; 57:1437–45.
14. Hawley JA, Burke LM, Phillips SM, Spriet LL. Nutritional modulation of training-induced skeletal muscle adaptations. J. Appl. Physiol. 2011; 110:834–45.
15. Krogh A, Lindhard J. The relative value of fat and carbohydrate as sources of muscular energy: with appendices on the correlation between standard metabolism and the respiratory quotient during rest and work. Biochem. J. 1920; 14:290–363.
16. Wojtaszewski JF, MacDonald C, Nielsen JN, et al. Regulation of 5’AMP-activated protein kinase activity and substrate utilization in exercising human skeletal muscle. Am. J. Physiol. Endocrinol. Metab. 2003; 284:E813–22.
17. Perry CG, Lally J, Holloway GP, Heigenhauser GJ, Bonen A, Spriet LL. Repeated transient mRNA bursts precede increases in transcriptional and mitochondrial proteins during training in human skeletal muscle. J. Physiol. 2010; 588(Pt. 23):4795–810.
18. Melkani GC, Panda S. Time-restricted feeding for prevention and treatment of cardiometabolic disorders: maintenance of metabolic rhythms reduce cardiometabolic disorders. J. Physiol. 2017; 595:3691–700.
19. Moro T, Tinsley G, Bianco A, et al. Effects of eight weeks of time-restricted feeding (16/8) on basal metabolism, maximal strength, body composition, inflammation, and cardiovascular risk factors in resistance-trained males. J. Transl. Med. 2016; 14.
20. Smith ST, LeSarge JC, Lemon PWR. Time-restricted eating in women—a pilot study. West Undergrad. Res. J. Health Nat. Sci. 2017; 8:1–6.
21. Gabel K, Hoddy KK, Haggerty N, et al. Effects of 8-hour time restricted feeding on body weight and metabolic disease risk factors in obese adults: a pilot study. Nutr. Healthy Aging. 2018; 4:345–53.
22. Antoni R, Robertson TM, Robertson MD, Johnston JD. A pilot feasibility study exploring the effects of a moderate time-restricted feeding intervention on energy intake, adiposity and metabolic physiology in free-living human subjects. Journal of Nutritional Science [Internet]. 2018 [cited 2018 Dec 7];7.
23. Parr EB, Coffey VG, Hawley JA. “Sarcobesity”: a metabolic conundrum. Maturitas. 2013; 74:109–13.
24. Tinsley GM, La Bounty PM. Effects of intermittent fasting on body composition and clinical health markers in humans. Nutr. Rev. 2015; 73:661–74.
25. Sutton EF, Beyl R, Early KS, Cefalu WT, Ravussin E, Peterson CM. Early time-restricted feeding improves insulin sensitivity, blood pressure, and oxidative stress even without weight loss in men with prediabetes. Cell Metab. 2018; 27:1212–1221.e3.
26. Gamble KL, Berry R, Frank SJ, Young ME. Circadian clock control of endocrine factors. Nat. Rev. Endocrinol. 2014; 10:466–75.
27. Bierwolf C, Kern W, Mölle M, Born J, Fehm H. Rhythms of pituitary-adrenal activity during sleep in patients with Cushing’s disease. Exp. Clin. Endocrinol. Diabetes. 2000; 108:470–9.
28. Van Cauter E, Blackman JD, Roland D, Spire JP, Refetoff S, Polonsky KS. Modulation of glucose regulation and insulin secretion by circadian rhythmicity and sleep. J. Clin. Investig. 1991; 88:934–42.
29. Sonnier T, Rood J, Gimble JM, Peterson CM. Glycemic control is impaired in the evening in prediabetes through multiple diurnal rhythms. J. Diabetes Complications. 2014; 28:836–43.
30. Imai S, Kajiyama S, Hashimoto Y, et al. Divided consumption of late-night-dinner improves glycemic excursions in patients with type 2 diabetes: a randomized cross-over clinical trial. Diabetes Res. Clin. Pract. 2017; 129:206–12.
31. Sato M, Nakamura K, Ogata H, et al. Acute effect of late evening meal on diurnal variation of blood glucose and energy metabolism. Obes. Res. Clin. Pract. 2011; 5:e220–8.
32. Carlson O, Martin B, Stote KS, et al. Impact of reduced meal frequency without caloric restriction on glucose regulation in healthy, normal-weight middle-aged men and women. Metabolism. 2007; 56: 1729–34.
33. Stote KS, Baer DJ, Spears K, et al. A controlled trial of reduced meal frequency without caloric restriction in healthy, normal-weight, middle-aged adults. Am. J. Clin. Nutr. 2007; 85:981–8.
34. Hutchison AT, Regmi P, Manoogian ENC, et al. Time-restricted feeding improves glucose tolerance in men at risk for type 2 diabetes: a randomized crossover trial. Obesity (Silver Spring). 2019; 27:724–32.
35. Morris CJ, Yang JN, Garcia JI, et al. Endogenous circadian system and circadian misalignment impact glucose tolerance via separate mechanisms in humans. Proc. Natl. Acad. Sci. U. S. A. 2015; 112:E2225–34.
36. Qian J, Morris CJ, Caputo R, Garaulet M, Scheer FAJL. Ghrelin is impacted by the endogenous circadian system and by circadian misalignment in humans. Int. J. Obes. (Lond). 2019; 43:1644–9.
37. Garaulet M, Gómez-Abellán P, Alburquerque-Béjar JJ, Lee YC, Ordovás JM, Scheer FA. Timing of food intake predicts weight loss effectiveness. Int. J. Obes. (Lond). 2013; 37:604–11.
38. Jakubowicz D, Barnea M, Wainstein J, Froy O. High caloric intake at breakfast vs. dinner differentially influences weight loss of overweight and obese women. Obesity (Silver Spring). 2013; 21:2504–12.
39. Monnier L. Is postprandial glucose a neglected cardiovascular risk factor in type 2 diabetes? Eur. J. Clin. Invest. 2000; (Suppl. 2):3–11.
40. Brandhorst S, Choi IY, Wei M, et al. A periodic diet that mimics fasting promotes multi-system regeneration, enhanced cognitive performance, and healthspan. Cell Metab. 2015; 22:86–99.
41. Schlierf G, Dorow E. Diurnal patterns of triglycerides, free fatty acids, blood sugar, and insulin during carbohydrate-induction in man and their modification by nocturnal suppression of lipolysis. J. Clin. Investig. 1973; 52:732–40.
42. Hatori M, Vollmers C, Zarrinpar A, et al. Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab. 2012; 15:848–60.
43. Wang JB, Patterson RE, Ang A, Emond JA, Shetty N, Arab L. Timing of energy intake during the day is associated with the risk of obesity in adults. J. Hum. Nutr. Diet. 2014; 27:255–62.
44. Baron KG, Reid KJ, Kern AS, Zee PC. Role of sleep timing in caloric intake and BMI. Obesity. 2011; 19:1374–81.
45. Reid KJ, Baron KG, Zee PC. Meal timing influences daily caloric intake in healthy adults. Nutr. Res. 2014; 34:930–5.
46. Lee CD, Blair SN, Jackson AS. Cardiorespiratory fitness, body composition, and all-cause and cardiovascular disease mortality in men. Am. J. Clin. Nutr. 1999; 69:373–80.
47. Booth FW, Gordon SE, Carlson CJ, Hamilton MT. Waging war on modern chronic diseases: primary prevention through exercise biology. J. Appl. Physiol. 2000; 88:774–87.
48. Ruegsegger GN, Booth FW. Health benefits of exercise. Cold Spring Harb. Perspect. Med. 2018; 8.
49. You T, Murphy KM, Lyles MF, Demons JL, Lenchik L, Nicklas BJ. Addition of aerobic exercise to dietary weight loss preferentially reduces abdominal adipocyte size. Int. J. Obes. (Lond). 2006; 30:1211–6.
50. Ballor DL, Keesey RE. A meta-analysis of the factors affecting exercise-induced changes in body mass, fat mass and fat-free mass in males and females. Int. J. Obes. 1991; 15:717–26.
51. Ballor DL, Katch VL, Becque MD, Marks CR. Resistance weight training during caloric restriction enhances lean body weight maintenance. Am. J. Clin. Nutr. 1988; 47:19–25.
52. McGlory C, van Vliet S, Stokes T, Mittendorfer B, Phillips SM. The impact of exercise and nutrition on the regulation of skeletal muscle mass. J. Physiol. 2019; 597:1251–8.
53. Sarma EA, Moyer A, Messina CR, et al. Is there a spillover effect of targeted dietary change on untargeted health behaviors? Evidence from a dietary modification trial. Health Educ. Behav. 2019; 46:569–81.
54. Johannessen KB, Oettingen G, Mayer D. Mental contrasting of a dieting wish improves self-reported health behaviour. Psychol. Health. 2012; (Suppl. 2):43–58.
55. Dutton GR, Napolitano MA, Whiteley JA, Marcus BH. Is physical activity a gateway behavior for diet? Findings from a physical activity trial. Prev. Med. 2008; 46:216–21.
56. Rhew I, Yasui Y, Sorensen B, et al. Effects of an exercise intervention on other health behaviors in overweight/obese post-menopausal women. Contemp. Clin. Trials. 2007; 28:472–81.
57. Fleig L, Lippke S, Pomp S, Schwarzer R. Intervention effects of exercise self-regulation on physical exercise and eating fruits and vegetables: a longitudinal study in orthopedic and cardiac rehabilitation. Prev. Med. 2011; 53:182–7.
58. Halliday TM, Davy BM, Clark AG, et al. Dietary intake modification in response to a participation in a resistance training program for sedentary older adults with prediabetes: findings from the Resist Diabetes study. Eat. Behav. 2014; 15:379–82.
59. Douglas JA, King JA, Clayton DJ, et al. Acute effects of exercise on appetite, ad libitum energy intake and appetite-regulatory hormones in lean and overweight/obese men and women. Int. J. Obes. Relat. Metab. Disord. 2017; 41:1737–44.
60. Schubert MM, Sabapathy S, Leveritt M, Desbrow B. Acute exercise and hormones related to appetite regulation: a meta-analysis. Sports Med. 2014; 44:387–403.
61. Dorling J, Broom D, Burns S, et al. Acute and chronic effects of exercise on appetite, energy intake, and appetite-related hormones: the modulating effect of adiposity, sex, and habitual physical activity. Nutrients. 2018; 10:1140.
62. King NA, Horner K, Hills AP, et al. Exercise, appetite and weight management: understanding the compensatory responses in eating behaviour and how they contribute to variability in exercise-induced weight loss. Br. J. Sports Med. 2012; 46:315–22.
63. King NA, Caudwell PP, Hopkins M, Stubbs JR, Naslund E, Blundell JE. Dual-process action of exercise on appetite control: increase in orexigenic drive but improvement in meal-induced satiety. Am. J. Clin. Nutr. 2009; 90:921–7.
64. Martins C, Kulseng B, King NA, Holst JJ, Blundell JE. The effects of exercise-induced weight loss on appetite-related peptides and motivation to eat. J. Clin. Endocrinol. Metabol. 2010; 95:1609–16.
65. Guelfi KJ, Donges CE, Duffield R. Beneficial effects of 12 weeks of aerobic compared with resistance exercise training on perceived appetite in previously sedentary overweight and obese men. Metabolism. 2013; 62:235–43.
66. Pil-Byung C, Shin-Hwan Y, Il-Gyu K, et al. Effects of exercise program on appetite-regulating hormones, inflammatory mediators, lipid profiles, and body composition in healthy men. J. Sports Med. Phys. Fitness. 2011; 51:654–63.
67. Richter EA, Hargreaves M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol. Rev. 2013; 93:993–1017.
68. Bird SR, Hawley JA. Update on the effects of physical activity on insulin sensitivity in humans. BMJ Open Sport Exerc. Med. 2017; 2:e000143.
69. Hawley JA, Lessard SJ. Exercise training-induced improvements in insulin action. Acta Physiol (Oxf). 2008; 192:127–35.
70. Snowling NJ, Hopkins WG. Effects of different modes of exercise training on glucose control and risk factors for complications in type 2 diabetic patients: a meta-analysis. Diabetes Care. 2006; 29:2518–27.
71. Dempsey PC, Blankenship JM, Larsen RN, et al. Interrupting prolonged sitting in type 2 diabetes: nocturnal persistence of improved glycaemic control. Diabetologia. 2017; 60:499–507.
72. Reynolds AN, Mann JI, Williams S, Venn BJ. Advice to walk after meals is more effective for lowering postprandial glycaemia in type 2 diabetes mellitus than advice that does not specify timing: a randomised crossover study. Diabetologia. 2016; 59:2572–8.
73. Goodpaster BH, Sparks LM. Metabolic flexibility in health and disease. Cell Metab. 2017; 25:1027–36.
74. Brouwers B, Hesselink MKC, Schrauwen P, Schrauwen-Hinderling VB. Effects of exercise training on intrahepatic lipid content in humans. Diabetologia. 2016; 59:2068–79.
75. Shojaee-Moradie F, Cuthbertson DJ, Barrett M, et al. Exercise training reduces liver fat and increases rates of VLDL clearance but not VLDL production in NAFLD. J. Clin. Endocrinol. Metab. 2016; 101:4219–28.
76. Leon AS, Sanchez OA. Response of blood lipids to exercise training alone or combined with dietary intervention. Med. Sci. Sports Exerc. 2001; 33:S502–15; discussion S528-529.
77. Lira FS, Yamashita AS, Uchida MC, et al. Low and moderate, rather than high intensity strength exercise induces benefit regarding plasma lipid profile. Diabetol. Metab. Syndr. 2010; 2:31.
78. Prabhakaran B, Dowling EA, Branch JD, Swain DP, Leutholtz BC. Effect of 14 weeks of resistance training on lipid profile and body fat percentage in premenopausal women. Br. J. Sports Med. 1999; 33:190–5.
79. Grace MS, Dempsey PC, Sethi P, et al. Breaking up prolonged sitting alters the postprandial plasma lipidomic profile of adults with type 2 diabetes. J. Clin. Endocrinol. Metab. 2017; 102:1991–9.
80. Savikj M, Gabriel BM, Alm PS, et al. Afternoon exercise is more efficacious than morning exercise at improving blood glucose levels in individuals with type 2 diabetes: a randomised crossover trial. Diabetologia. 2019; 62:233–7.
81. Heden TD, Kanaley JA. Syncing exercise with meals and circadian clocks. Exerc. Sport Sci. Rev. 2019; 47:22–8.
82. Guette M, Gondin J, Martin A. Time-of-day effect on the torque and neuromuscular properties of dominant and non-dominant quadriceps femoris. Chronobiol. Int. 2005; 22:541–58.
83. Martin A, Carpentier A, Guissard N, van Hoecke J, Duchateau J. Effect of time of day on force variation in a human muscle. Muscle Nerve. 1999; 22:1380–7.
84. Brooker PG, Gomersall SR, King NA, Leveritt MD. The feasibility and acceptability of morning versus evening exercise for overweight and obese adults: a randomized controlled trial. Contemp Clin Trials Commun. 2019; 14:100320.
85. Grgic J, Lazinica B, Garofolini A, Schoenfeld BJ, Saner NJ, Mikulic P. The effects of time of day-specific resistance training on adaptations in skeletal muscle hypertrophy and muscle strength: a systematic review and meta-analysis. Chronobiol. Int. 2019; 36:449–60.
86. Ezagouri S, Zwighaft Z, Sobel J, et al. Physiological and molecular dissection of daily variance in exercise capacity. Cell Metab. 2019.
87. van Moorsel D, Hansen J, Havekes B, et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab. 2016; 5:635–45.
88. Hawley JA, Hargreaves M, Joyner MJ, Zierath JR. Integrative biology of exercise. Cell. 2014; 159:738–49.
89. Tinsley GM, Forsse JS, Butler NK, et al. Time-restricted feeding in young men performing resistance training: a randomized controlled trial. Eur. J. Sport Sci. 2017; 17:200–7.
90. Villareal DT, Chode S, Parimi N, et al. Weight loss, exercise, or both and physical function in obese older adults. N. Engl. J. Med. 2011; 364:1218–29.
91. Vijan S, Stuart NS, Fitzgerald JT, et al. Barriers to following dietary recommendations in type 2 diabetes. Diabet. Med. 2005; 22:32–8.
92. Trost SG, Owen N, Bauman AE, Sallis JF, Brown W. Correlates of adults’ participation in physical activity: review and update. Med. Sci. Sports Exerc. 2002; 34:1996–2001.
93. Gibson AA, Sainsbury A. Strategies to improve adherence to dietary weight loss interventions in research and real-world settings. Behav Sci (basel). 2017; 7:pii: E44.
